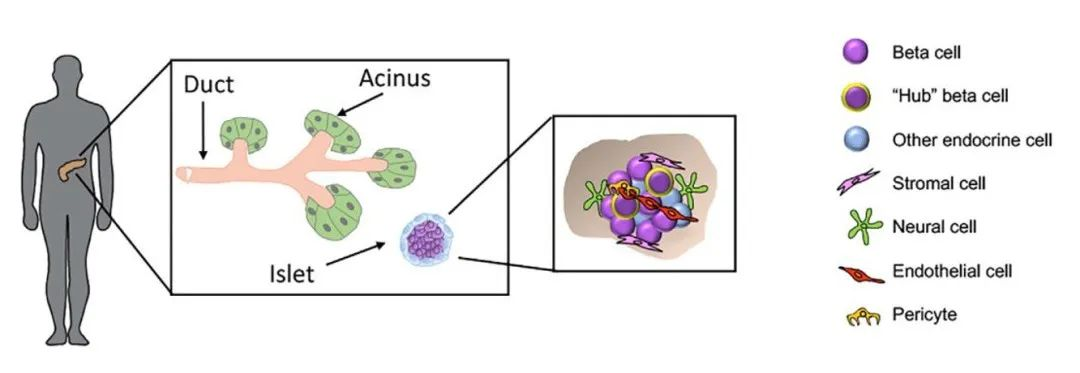
机体内的β胰岛细胞不是独立存在的。事实上,β细胞功能的维持高度依赖于胰岛复杂的细胞结构,而分离态的胰岛细胞与完整结构中的胰岛细胞的行为不同。比如,由于基础胰岛素分泌量和葡萄糖刺激下最大胰岛素分泌量下降,分离态的β细胞跟完整结构状态中的细胞相比,其葡萄糖刺激下的胰岛素分泌功能低下。加之其它机制,像细胞-细胞信号交流的协调、细胞间隙连接蛋白Connexin-36等均在维持胰岛素水平波动中与β细胞联结和胰岛同步过程发挥重要作用。
考虑生产最理想效果的治疗糖尿病治的人胚胎干细胞,所以制备细胞时必须考虑如何重建胰岛细胞与细胞的接触和胰岛与微环境交流的结构。
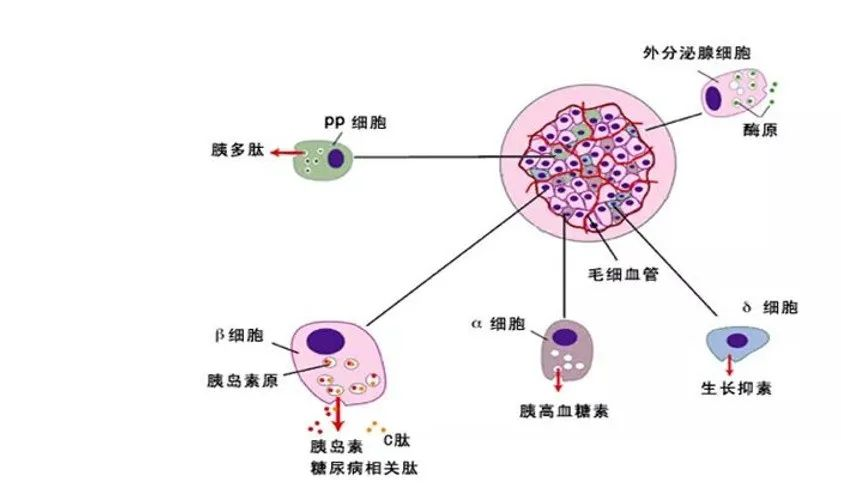
β细胞一个主导性功能是与胰岛小生境中其它细胞的信息交流,包括多种非内分泌型细胞,如内皮细胞、周细胞、神经细胞和间充质细胞。胰腺中胰岛的血管高度发达,每一个β细胞都与内皮细胞产生一个或多个接触,并在接触处形成特殊的超微结构。
在胰腺发育过程中,最初是内皮细胞被内分泌细胞分泌的VEGF-A招募到迅速生长的胰岛。然后是内皮细胞合成和分泌胰岛膜基质,并作为β细胞生长、存活和功能的关键调节因子。胰岛血管小生境不仅包括内皮细胞,还包括周细胞。周细胞包裹在内皮细胞管周围,以提供结构支持和产生成熟功能的血管并调节内皮细胞的增殖、存活和功能。周细胞在正常胰岛功能中的作用还不完全清楚,而遗传敲除研究则表明,成年鼠胰岛中周细胞的缺失会导致胰岛素表达和葡萄糖清除的障碍。
胰岛细胞结构对内分泌功能很重要,各种方法被用于体外产生工程胰岛,或所谓的‘假胰岛’。多项研究报告表明,无论是在体外还是在体内,移植了假胰岛的再聚体之后,功能都得到了改善。也有证据表明,与仅由β细胞组成的假胰岛相比,β细胞与内皮祖细胞重新聚集在一起后,GSIS(葡萄糖刺激的胰岛素分泌)得到了改善。
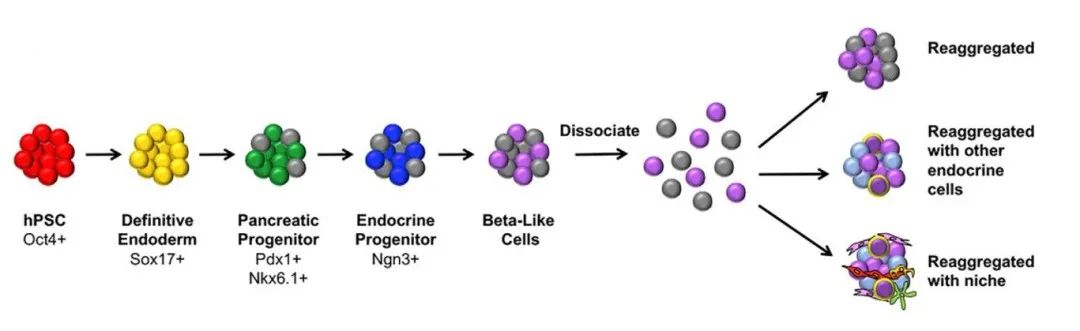
总之,确定最适合人体胰岛功能的细胞组成和结构布局。种子细胞的来源有限。一种选择是从胚胎干细胞(hESCs)或诱导多能干细胞(iPSCs)中产生胰岛β细胞。另一个挑战是,目前创建人工胰岛的技术依赖于内分泌细胞和非内分泌细胞之间的胰岛类器官。也许有一天,胰岛组织的3D打印或许成为可能,从而能够完成所希望的结构。
使用β细胞替代治疗1型糖尿病的成功,再加上hESC-或iPSC衍生β细胞的生产,为有效治疗该疾病提供了路线图。
然而,免疫排斥问题是细胞替代疗法治疗糖尿病的主要障碍。目前的免疫抑制剂是有效的,但需要终生使用。

在1型糖尿病患者中,异基因β细胞面临同种免疫介导的排斥反应,如果不被抑制,可以在几天内清除移植的细胞。T细胞是主要因素,其激活是由于T细胞受体(TCR)识别MHC结合的抗原肽所致。MHC蛋白的HLA是异基因免疫攻击的主要靶点,女性受体中出现的男性抗原或线粒体抗原,也能引起排斥反应,尽管速度较慢。
免疫抑制可避免异基因β细胞遭受排斥,但移植了患者的免疫系统,容易遭受感染和恶性肿瘤的侵袭。一种理想的策略是训练免疫系统接受移植的细胞,避免慢性全身免疫抑制。许多临床前动物模型已经实现了对移植组织的免疫耐受,目前,正在为人类开发潜在的耐受性疗法。
在过去20年中,人们一直努力研究诱导移植耐受性的策略。策略之一是:构建供者-受体造血嵌合体。供体免疫细胞的存在,将培养受体免疫细胞接受供体来源的细胞作为自身细胞,从而防止移植排斥。但是混合嵌合状态不稳定,导致宿主或供体免疫系统失衡而被一方主导并接管。当供体细胞占优势时,移植物抗宿主病的风险就很高;当受体细胞占上风时,对供体的耐受性往往会丧失。另一种策略是:用过继细胞疗法促进Treg功能。但也有问题,大量的可对供体反应的效应T细胞可以压倒Treg介导的抑制。用Treg控制排斥反应,需要减少受体体内针对供体产生反应的T细胞。

在1型糖尿病患者中,胰岛自身抗原特异性T细胞也可以攻击和破坏移植的β细胞,从而促使移植的β细胞被排斥。有趣的是,通常的实体器官免疫抑制剂并不能有效地诱导糖尿病的缓解。
大多数常用于预防同种免疫介导的移植排斥的免疫抑制药物,则可导致短期糖尿病缓解,但没有长期疗效。在免疫抑制的胰腺和肾移植受者中,传统药物用于抑制自身免疫反应,也观察到攻击胰岛细胞的自身免疫复发。T细胞和B细胞靶向治疗,如抗CD3,可使一些新的1型糖尿病患者的β细胞功能暂时停止下降。抗胸腺细胞球蛋白是一种在器官移植中常用于诱导T细胞衰竭的药物,在高剂量时不能防止β细胞丢失,低剂量与G-CSF联合使用时具有短期效益。
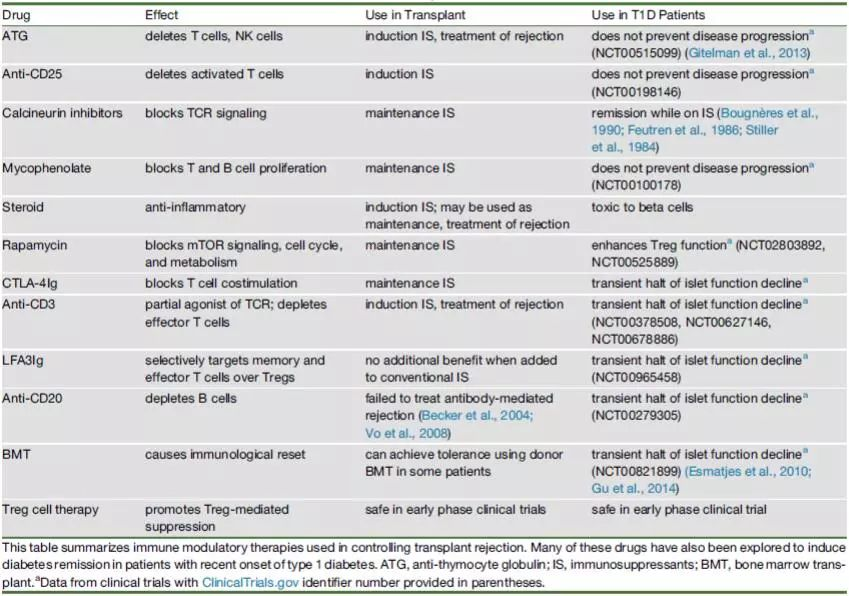
除了免疫调节策略外,也有开发胰岛抗原特异性治疗策略的。临床前的数据表明,用胰岛抗原制备的肽疫苗或纳米微粒可以靶向于特定的效应细胞来诱导免疫耐受,但在患者中的有效性仍有待临床试验证明。抗原特异性免疫治疗面临的挑战是免疫系统所针对的胰岛抗原的数量;仅解除针对一种或一群胰岛抗原特异性T细胞的杀伤功能不足以改变疾病的进程。此外,在不同的患者、不同的疾病阶段,胰岛抗原的特异性可能是不同的,因此很难知道哪些特异胰岛抗原才是目标。诱导主要抗原特异的免疫调控的方法可能更有效,更容易应用于不同的患者群体。
Treg细胞治疗有吸引力的特点,主要在于关乎效应T细胞对主要抗原特异性反应的调节。例如,Treg通过‘关联抑制’和‘传染性耐受’来控制不希望的免疫反应。在关联抑制中,由一个抗原激活的Treg可以抑制在同一组织微环境中出现的针对其它抗原的反应。
在传染性耐受中,Treg创造了一个耐受性组织微环境,从而使附近其它的激活T细胞采取调节而不是效应命运。这使得Treg的抑制性能够随着时间的推移而传播,而不仅仅局限于起始细胞的存在。这些特性确保特异性有限的Treg能够对局部其它免疫细胞进行特异、显著和持久的控制。的确,单次注射胰岛抗原特异性Treg可诱导自身免疫性非肥胖糖尿病小鼠糖尿病终生的缓解。目前,Treg细胞治疗1型糖尿病患者的临床试验正在进行中,显示了其可行性和安全性。









